Immun-Checkpoint - Info
Immun-Checkpoints
Ein zentraler Baustein unseres Immunsystems sind T-Lymphozyten (kurz: T-Zellen). Sie gehören zu der Gruppe der Leukozyten (weißen Blutzellen). Neben den B-Lymphozyten sind sie der wichtigste Teil der erworbenen (adaptiven) Immunantwort.
Das Immunsystem wird aktiviert wenn ein T-Zell-Rezeptor (TCR) ein entsprechendes Signal erhält.
Diese Signal ist ein passendes Antigen, wie beim Schlüssel-Schloss Prinzip. Dieses Antigen wird von einer besonderen Zelle präsentiert (APCs).
Der Grund hierfür ist, dass T-Lymphozyten nicht einfach Antigene erkennen können. Diese Antigene müssen zuvor aufbereitet werden. Im Anschluss werden sie dann auf dem vom MHC codierten Klasse-I- und Klasse-II-Rezeptoren auf der Zelloberfläche präsentiert.
Damit die hierdurch hervorgerufene Reaktion nicht unkontrolliert abläuft gibt es Signale, die hemmend oder stimulierend wirken können:
Auf der Zelloberfläche (Membran) von T-Lymphozyten sitzen Rezeptoren, die als Immun-Checkpoints bezeichnet werden. Sie sind, aufgrund ihres Einflusses auf die Immunantwort, unterteilbar in antiinflammatorische (inhibitorische) und proinflammatorische (stimulatorische) Immun-Checkpoints.
Antiinflammatorische (inhibitorische) Immun-Checkpoints
| CTLA-4 | PD-1 | LAG3 | TIM-3 | NOX2 |
| KIT | VISTA | SIGLEC7 | B7-H3 | B7-H4 |
| BTLA | A2AR |
Proinflammatorische (stimulatorische) Immun-Checkpoints
| CD27 | CD28 | CD40 | CD70 | CD86 |
| CD122 | CD134 (OX40) | CD137 | GITR | ICOS |
Tabelle 1: Übersicht einiger bekannter Immun-Checkpoint Rezeptor-Liganden Pärchen, ihrer Wirkung und Lage.
| Wirkung | Funktion | T-Zelle | Antigenpräsentierende Zelle | Funktion |
|---|---|---|---|---|
| antiinflammatorisch | Rezeptor | BTLA | HVEM | Ligand |
| antiinflammatorisch | Rezeptor | CTLA-4 | CD80(B7-H1) / CD86(B7-H2) | Ligand |
| antiinflammatorisch | Rezeptor | TIGIT | CD155 | Ligand |
| antiinflammatorisch | Rezeptor | PD-1 | PD-L1 | Ligand |
| antiinflammatorisch | Rezeptor | PD-1 | PD-L2 | Ligand |
| antiinflammatorisch | Rezeptor | TIM-3 | Galectin-9 | Ligand |
| antiinflammatorisch | Rezeptor | LAG3 | MHC class II | Ligand |
| antiinflammatorisch | Rezeptor | A2AR | - | Ligand |
| antiinflammatorisch | Ligand/Rezeptor | VISTA | - | Ligand |
| antiinflammatorisch | Ligand/Rezeptor | SIGLEC7 (CD328) | Sialylated glycans | Ligand |
| antiinflammatorisch | Rezeptor | - | B7-H3 (CD276) | Ligand |
| antiinflammatorisch | Rezeptor | - | B7-H4 | Ligand |
| proinflammatorisch | Rezeptor | GITR | GITRL | Ligand |
| proinflammatorisch | Rezeptor | OX40 | OX40L | Ligand |
| proinflammatorisch | Rezeptor | 4-1BB (CD137) | 4-1BBL | Ligand |
| proinflammatorisch | Rezeptor | CD27 | CD70 | Ligand |
| proinflammatorisch | Rezeptor | ICOS | ICOSL | Ligand |
| proinflammatorisch | Ligand | CD28 | CD80(B7-H1) / CD86(B7-H2) | Rezeptor |
| proinflammatorisch | Ligand | CD40L | CD40 | Rezeptor |
Die entsprechenden Gegenstücke zu den Rezeptoren, die Liganden, befinden sich auf der Oberfläche von anderen Zellen.
Das Zusammenspiel der Beiden hilft dem Immunsystem dabei eine Immunreaktion gegenüber körpereigenen Zellen zu vermeiden.
Ist diese Interaktion gestört kannes zum Beispiel zu Autoimmunerkrankungen kommen.
Tumorzellen zeigen eine deutliche überexpression dieser Rezeptor-Gegenstücke, wodurch es ihnen gelingt der Erkennung durch die T-Zellen zu entkommen. Dieses Phänomen wird auch als Immunevasion bezeichnet.
Somit tarnen sich die Tumorzellen als "harmlose", körpereigene Zellen und werden somit nicht vom Immunsystem erkannt.
Krebsimmuntherapie (Immun-Checkpoint Therapie)
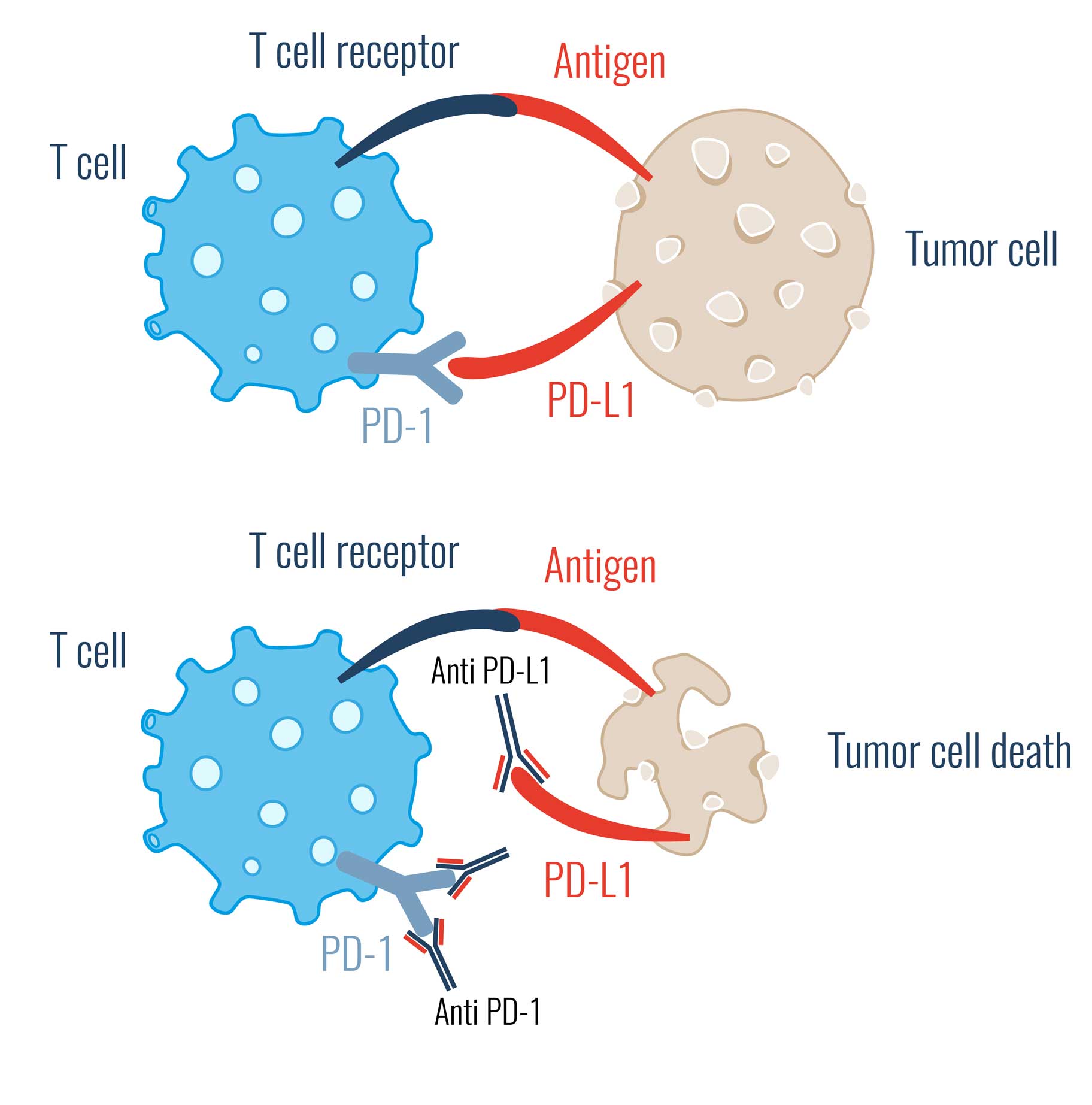
In der Medizin beschäftigt sich der Bereich der Krebsimmuntherapie (Immun-Checkpoint Therapie) mit Immun-Checkpoint-Inhibitoren. Dies sind Substanzen, wie z.B. in vivo Antikörper, die an Immun-Checkpoints binden. Hierdurch unterbinden sie die Möglichkeit der Tumorzelle, der Erkennung durch T-Zellen zu entkommen.
Dabei wird die Interaktion zwischen dem Rezeptor und seinem Liganden verhindert und somit das "Entwarnungs-Signal" der Krebszelle nicht mehr an die kontrollierende Immunzellen weitergegeben.
Das Immunsystem fällt nun nicht mehr auf die Tarnung der Krebszellen rein.
Folglich wird die körpereigene Immunantwort im Kampf gegen die Tumorzelle durch Immun-Checkpoint-Inhibitoren unterstützt.
Konkret sind drei Immun-Checkpoints besonders bekannt.
CTLA-4 Inhibitoren
CTLA-4 ist ein Ligand der auf der Oberfläche von T-Zellen gefunden wird.
Bindet CTLA-4 an CD80 oder CD86 werden regulatorische T-Zellen "aus"-geschaltet und werden somit nicht aktiv.
Ein Hemmung von CTLA-4 bewirkt daher, dass die Immunzellen nicht inaktiv werden und weiterhin gegen Krebszellen vorgehen.
PD-1 Inhibitoren
PD-1 ist ein Oberflächenrezeptor auf T-Zellen.
Im gesunden Umwelt dient PD-1 als Schutzmechanismus gegen eine Überreaktion des Immunsystems. Auch hier kann PD-1 als eine Art "Aus"-Schalte gesehen werden.
Eine Krebszelle kann diesen Schalter nutzen, um eine Immunreaktion gegen sich zu verhindern. Blockiert man aber diesen Schalter mit einem PD-1 Inhibitor nimmt man quasi die Sicherung raus: Egal wie oft man den Schalter benutzt, es passiert nichts.
PD-L1 Inhibitoren
PD-L1 ist der Auslöser vom PD-1 Signal. Wird nun PD-L1 blockiert kann auch somit keine "Aus"-Siganl ausgelöst werden.
Zu den bekanntesten Immun-Checkpoints zählen PD-1 und CTLA-4. James P. Allison und Tasuku Honjo haben 2018 für ihre Forschung im Bereich der Immune-Checkpoints den Nobelpreis für Medizin erhalten. Gegen diese Immun-Checkpoints wurden die beiden Inhibitoren Nivolumab und Ipilimumab entwickelt, die bereits für die klinische Anwendung zugelassen sind.
VISTA
Der monoklonale Antikörper (13F3) bindet an den murinen Immun-Checkpoint „V-domain Immunoglobulin Suppressor of T cell Activation“ (VISTA), auch bekannt als PD-1H und B7-H5. VISTA ist ein negativer Immun-Checkpunkt, der die Zytokinproduktion von T-Zellen und deren Proliferation hemmt. Tumor-infiltrierende Lymphozyten (myeloide Zellen und regulatorische T-Zellen) weisen eine deutliche überexpression von VISTA auf ihrer Zelloberfläche auf, wodurch die Zytokinproduktion und Proliferation von T-Zellen stärker gehemmt wird, als unter normalen physiologischen Bedingungen. In verschiedenen präklinischen Studien hat die spezifische Blockierung von VISTA, mittels des monoklonalen 13F3-Antikörpers, zu einem verzögerten Tumorwachstum geführt. Des Weiteren wird die Hemmung des Immun-Checkpoints VISTA für die Behandlung von soliden Tumoren und Lymphomen im Menschen in klinischen Studien untersucht. Dieser Therapieansatz stellt einen vielversprechenden Ansatz für die zukünftige Krebsimmuntherapie dar.
Referenzen bezüglich des Klons 13F3:



