Proteine - Info
Was sind Proteine?
Produkte

Proteine sind Makromoleküle, die die unterschiedlichsten Formen und Funktionen innerhalb eines Organismus haben und in jeder Zelle vorkommen. Sie übernehmen unter anderem eine wichtige Rolle in:
- • der Steuerung von Stoffwechselprozessen (Enzyme)
- • der Übertragung von Signalen innerhalb des Organismus (Hormone, Rezeptoren, Membrantransportern)
- • dem Wachstum und der Differenzierung von Zellen (Cytokine)
- • dem Transport von Stoffen (Hämoglobin, Albumin, Transferrin, thyroxin-bindendes Globulin (TBG)
- • der Stabilisierung von Stützstrukturen (Kollagen, Elastin)
- • der Abwehr von Fremdkörpern (Antikörper)
Genauso vielfältig wie die Funktionen der Proteine ist auch ihre Form. Proteine werden aus einem Bausatz von zwanzig verschiedenen Aminosäuren zusammengesetzt, die über kovalente Bindungen miteinander zu langen Ketten (Polypeptide) verknüpft werden. Die Aminosäuresequenz der Polypeptide ist durch die im Zellkern befindliche DNA kodiert. Von dieser wird durch ein Enzym (RNA-Polymerase) eine modifizierte Abschrift eines Gens (definierter DNA-Abschnitt) erstellt (Transkription), die nach weiteren Veränderungen den Zellkern als fertigen Protein-Bauplan (mRNA) verlässt. Im Cytosol wird dieser mithilfe eines Enzym-Komplexes (Ribosom) abgelesen und die entsprechenden Aminosäuren in der richtigen Reihenfolge miteinander verbunden (Transkription). Ab einer Kettenlänge von 100 Aminosäuren spricht man von Proteinen, kürzere Ketten werden als Peptide bezeichnet.
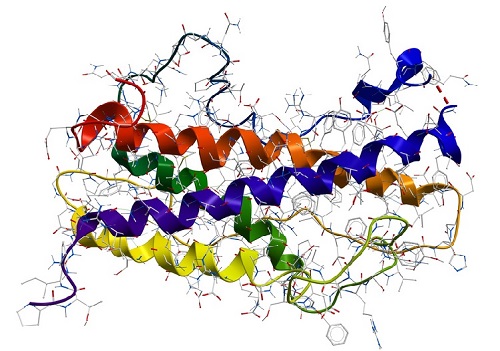
Proteinstruktur
Proteine können aus einem oder mehreren Polypeptiden bestehen. Die Aminosäureabfolge der Polypeptide eines Proteins wird als dessen Primärstruktur bezeichnet. Zwischen den einzelnen Aminosäuren der Polypeptide können sich in regelmäßigen Abständen Wasserstoffbrücken ausbilden, die die Konformation des Proteins prägen. Jedes Protein enthält zwei wiederkehrende, aus Wasserstoffbrücken resultierende Strukturen: die α-Helix und das β-Faltblatt. Diese beiden Muster werden auch als die Sekundärstruktur des Proteins bezeichnet. Hydrophobe Wechselwirkungen (auch Van-der-Waals-Kräfte) zwischen den Seitenketten der Aminosäuren bedingen die räumliche Anordnung von α-Helices und β-Faltblättern zu der sogenannten Tertiärstruktur. Diese kann zusätzlich durch Disulfidbrücken zwischen den Schwefelatomen zweier Monomere der Aminosäure Cystein verstärkt werden. Besteht ein Protein aus mehreren Polypeptiden, so wird die Zusammenlagerung dieser zu einem funktionsfähigen Molekül als Quartärstruktur bezeichnet.
Proteinkonformation
Eine Proteinkonformation bezieht sich auf die dreidimensionale Form oder Anordnung eines Proteinmoleküls im Raum. Proteine sind komplexe Biomoleküle, die aus Ketten von Aminosäuren bestehen, die sich in spezifische dreidimensionale Strukturen falten, die für ihre biologische Funktion entscheidend sind. Die Sequenz der Aminosäuren in einem Protein bestimmt seine Primärstruktur, und die Art und Weise, in der sich das Protein in eine bestimmte Form faltet, wird als Konformation oder Tertiärstruktur bezeichnet.
Die Proteinkonformation wird durch verschiedene Faktoren bestimmt, darunter die Sequenz und die Eigenschaften der Aminosäuren sowie die Wechselwirkungen zwischen den verschiedenen Teilen des Proteinmoleküls, wie Wasserstoffbrückenbindungen, elektrostatische Wechselwirkungen, van-der-Waals-Kräfte und hydrophobe Wechselwirkungen. Diese Wechselwirkungen bestimmen, wie sich das Protein faltet und im Raum anordnet, um eine stabile dreidimensionale Struktur anzunehmen.
Proteine können verschiedene Arten von Konformationen aufweisen, darunter Alpha-Helices, Beta-Faltblätter, Schleifen, Windungen und andere strukturelle Motive. Die spezifische Konformation eines Proteins ist entscheidend für seine Funktion, da sie bestimmt, wie das Protein mit anderen Molekülen in seiner Umgebung interagiert, z. B. mit anderen Proteinen, Nukleinsäuren oder kleinen Molekülen. Veränderungen in der Proteinkonformation können erhebliche Auswirkungen auf die Aktivität, Stabilität und Bindungseigenschaften eines Proteins haben und durch verschiedene Faktoren ausgelöst werden, z. B. durch Veränderungen des pH-Werts, der Temperatur oder durch das Vorhandensein bestimmter Moleküle.
Das Verständnis der Proteinkonformation ist in Bereichen wie der Biochemie, der Molekularbiologie und der Arzneimittelentdeckung von entscheidender Bedeutung, da es Einblicke in die Struktur-Funktions-Beziehungen von Proteinen, in Protein-Protein-Wechselwirkungen und in Arzneimittel-Protein-Wechselwirkungen ermöglicht. Experimentelle Techniken wie Röntgenkristallographie, kernmagnetische Resonanzspektroskopie (NMR) und computergestützte Modellierung werden eingesetzt, um die Proteinkonformation zu untersuchen und die komplexen dreidimensionalen Strukturen von Proteinen aufzuklären.
Was geschieht bei einer Denaturierung?
Die Konformation eines Proteins ist entscheidend für dessen spezifische Funktion. So führt ein Verlust der Konformation (Denaturierung) fast immer auch zu einem Verlust der Aktivität. Verschiedene äußere Einflüsse, wie große Hitze, energiereiche Strahlung oder verschiedene Chemikalien, z. B. Salze, Säuren und Basen, können sich negativ auf die Form und Funktion von Proteinen auswirken.
Bei einer Denaturierung können die Wasserstoff- und Disulfidbrücken, Ionenbindungen und hydrophobe Wechselwirkungen aufgebrochen werden, aber nicht die kovalenten Bindungen zwischen den Aminosäuren. Aus diesem Grund sind von den Veränderungen bei einer Denaturierung vor allem die Sekundär- und Tertiärstruktur (wenn vorhanden auch die Quartärstruktur) der Proteine betroffen, während die Primärstruktur erhalten bleibt.



